Приложение 3
Насыщаемость ковалентной связи.Атом может образовывать ковалентную связь с другим атомом за счет неспаренного электрона (обменный механизм), а также за счет неподеленной электронной пары или вакантной орбитали (донорно-акцепторный механизм). Поскольку набор этих возможностей ограничен, ограничено и максимальное число ковалент-ных связей, которые может образовывать атом химического элемента. Поэтому говорят, что ковалентная связь характеризуется насыщаемостью. Например, атом водорода, обладающий единственным электроном на единственной 1 я-орби-гали, способен образовывать только одну ковалентную связь. Атом азота с электронной конфигурацией валентных электронов 2в 2 2р 3 может за счет трех неспаренных электронов образовывать три ковалентные связи по обменному механизму и четвертую — за счет пары 2в-электронов по донорно-акценторному, выступая при этом в роли донора. Таким образом, максимальная валентность азота равна четырем в отличие от высшей степени окисления, равной +5.
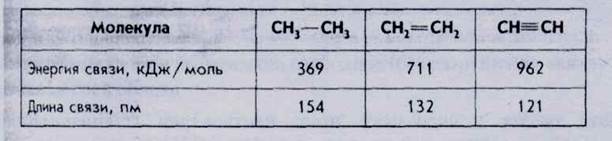
Кратность ковалентной связи.Число общих электронных пар, связывающих два атома в молекуле, называется кратностью ковалентной связи. Кратность влияет на энергию разрыва химической связи, а также на длину химической связи, т. е. межъядерное расстояние. Так, например, связь между атомами углерода в молекуле этана СгНб осуществляется за счет одной электронной пары, т. е. связь одинарная, ее кратность равна 1.
Связь в молекуле этилена СгН4 двойная (за счет двух электронных пар), ее кратность равна 2.
Связь в молекуле ацетилена СгЬЬ тройная, ее кратность равна 3. Сравним энергии и длины связей в этих молекулах (табл.16).
Итак, с увеличением кратности возрастает энергия разрыва связи и уменьшается длина связи.
Типы ковалентной связи по способу перекрыванияорбиталей. В зависимости от способа перекрывания электронных орбиталей различают — и -ковалентные связи.
Связь (сигма-связь) — — наиболее универсальный вид связи, которая образуется при перекрывании s—s-, s—р-, р—р— и других орбиталей (рис. 13).

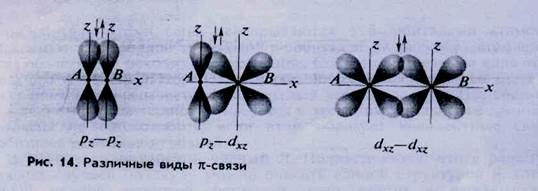
· область перекрывания (область повышенной электронной плотности) располагается на линии, соединяющей центры ядер атомов (линии связи);
· электронное облако (орбиталь) симметрично относительно линии связи. Такой вид симметрии называется цилиндрической или осевой, так как линия связи является для образующегося электронного облака осью вращения;
· возможно свободное вращение облака a-связи вокруг линии связи без ее
· Связъ (пи-связь) может возникать при взаимодействии р—р- ,p-d или d-d-орбиталей
· образуются две области перекрывания (повышенной электронной плотности), ни одна из которых не лежит на линии связи;
· электронное облако (орбиталь) симметрично относительно плоскости, проходящей через линию связи и перпендикулярно осям орбиталей. Такой вид симметрии называется зеркальной или плоскостной;
· вокруг линии связи невозможно свободное (без разрушения связи) вращение образовавшегося облака.
Направленность ковалентной связи.Если один и тот же атом образует несколько ковалентных связей, то они располагаются в пространстве под определенными углами. Направленность ковалентной связи обусловлена тем, что р-, d- и f-орбитали определенным образом ориентированы в пространстве. Направленность ковалентной связи влияет на форму молекул веществ, их размеры, межатомные расстояния, валентный угол, т. е. на геометрию молекул.
| Мы уже видели, что при образовании ковалентной связи происходит перекрывание атомных орбиталей взаимодействующих атомов в областях, где орбиталь имеет максимальную электронную плотность. На основании этого можно определить валентные углы для данной молекулы. Например, определим валентный угол в молекуле сероводорода Н 2S . |  |
Структурная формула молекулы сероводорода H-S-H. Пространственное строение молекулы определяется электронной структурой центрального атома, т. е. атома, образующего наибольшее число химических связей. В молекуле сероводорода это атом серы. Валентные электроны атома серы находятся на А — подуровне, угол между осями р-орбиталей — 90° (рис. 15).
р-Орбитали атома серы перекрываются с 8-орбиталями атомов водорода. Максимум электронной плотности р-орбиталей на рисунке затемнен. Именно в этих областях происходит перекрывание. Соединив отрезками ядра атомов Н и 8, получим валентный угол. Из рисунка видно, что он должен быть равен 90°. Эксперимент показывает, что валентный угол в молекуле H2S составляет 92°, т. е. в данном случае теория согласуется с экспериментальными данными. Однако согласия не наблюдается, если атом образует ковалентные связи за счет орбиталей разных подуровней.
В 1931 г. американский ученый Л. Полингдоказал, что в ряде практически важных случаев молекулу можно описать единой структурой и, следовательно, одной полной волновой функцией, если ввести в рассмотрение теорию гибридизации атомных орбиталей.
Гибридизация атомных орбиталей — это смешение различных атомных орбиталей данного атома в процессе его химического взаимодействия с другими атомами, приводящее к образованию гибридных орбиталей, локализованных в области между двумя атомами.
Рассмотрим понятие «гибридизация» на примере атома углерода и молекулы метана СН4.
Атом углерода имеет электронную конфигурацию

Ответы



ch4 + 2o2 = co2 +2h2o
объем метана v(ch4)= v*0.95=235.8*0.95=224.01 л
n=v/vm n(co2)=n(ch4)=v/vm=224.01/22.4=10 моль

можно просто прилить кислоту например соляную, тогда в пробирке с карбонатом будем наблюдать выделение пузырьков газа (если в пробирках раствор) ну или разложение его (в случае твердого вещества), в пробирке с сульфатом этого не произойдет, в нее для достоверности можно прилить хлорид бария — выпадет осадок белый сульфата
na2co3 + 2hcl = 2nacl + h2o + co2
2na(+) + co3(2-) + 2h(+) + = 2na(+) + + h2o + co2
na2so4 + bacl2 = 2nacl + baso4
2na(+) + so4(2-) + ba(2+) + = 2na(+) + + baso4
![]()
![]()
Я думаю, правильный ответ 2).
6 связей.
Так как к каждому атому углерода подсоединяется 3 атома водорода. А атомов углерода 2.
2*3=6.
Другие вопросы из категории
a) Fe(NO₃)₂ + NaOH —>
б) CaCl₂ + K₂CO₃ —>
метилофого эфира этановой кистоты
г/мл) может прореагировать с исходной смесью, если известно, что массовая доля углерода в ней составляет 70%.
ПОМОГАЙТЕ БРАТЦЫ ПЛИИЗ!
HCl + KMnO4 = MnCl2 + KCl + Cl2 + H2O
укажите окислитель и восстановитель в этой реакции
Читайте также
2.Ионной связью образовано каждое из 2 веществ:
1)бромоводород и оксид углерода(4)
2)барий и кобальт
3)нитрид магния и сульфид бария
4)хлорид натрия и фосфин
3.Формула вещества, образованного ковалентной полярной связью:
1.Nal
2.So4
3.Al
4.P4
4.Cоединениями с ионной и ковалентной полярной связью являются соответственно:
1.флорид кальция и оксид бария
2.бромид калия и сероводор
3.иодид натрия и йод
4.оксид углерода(2) и сульфад натрия
б) К гомологическому ряду циклоалканов относится вещество, молекулярная формула которого
1)C2H4
2)C4H8
3)C5H12
4)C6H6
в)Циклогексан реагирует с
1)Br2
2)N2
3)H2S
4)CO2
1) СН4 Н2 Сl2 2)NH3 HBr CO2 3) PCl3 KCl CCl4 4) H2S SO2 LiF
12. В каком ряду перечислены вещества только с ионным типом связи:
1) F2O LiF SF4 2) PCl3 NaCl CO2 3) KF Li2O BaCl2 4) СаF2 CH4 CCl4
13. Соединение с ионной связью образуется при взаимодействии
1) CH4 и O2 2)NH3 и HCl 3) C2H6 и HNO3 4) SO3 и H2O
14. В каком веществе все химические связи — ковалентные неполярные?
1) Алмаз 2) Оксид углерода (IV) 3) Золото 4) Метан
15. Связь, образующаяся между элементами с порядковыми номерами 15 и 53
1)ионная 2)металлическая
3)ковалентная неполярная 4)ковалентная полярная
16. Водородная связь образуется между молекулами
1) этана 2) бензола 3) водорода 4) этанола
17. В каком веществе есть водородные связи?
1) Сероводород 2)Лед 3) Бромоводород 4) Бензол
18.В каком веществе есть одновременно ионные и ковалентные химические связи?
1) Хлорид натрия 2) Хлороводород 3) Сульфат натрия 4) Фосфорная кислота
19. Более выраженный ионный характер имеет химическая связь в молекуле
1)бромида лития 2)хлорида меди 3)карбида кальция 4)фторида калия
20. Тремя общими электронными парами образована ковалентная связь в молекуле 1) азота 2) сероводорода 3) метана 4) хлора
21.Сколько электронов участвует в образовании химических связей в молекуле воды? 1) 2 2) 3 3) 4 4) 18
22.Четыре ковалентные связи содержит молекула: 1) СО2 2) С2H4 3) Р4 4) С3Н4
в.ковалентная полярная г.ковалентная неполярная металлическая 2.в узлах кристалической решетки кремния находятся а.молекулы б.ионы в.атомы г.атомы и ионы 3.в каком соединение ковалентная связь наиболее полярна? а.H2O б.NO2 в.CO2 г.SO2 4.для молекулы воды характерна связь а.ковалентная неполярная ионная б.ковалентная полярная ионная в.ковалентная полярная водородная г.ковалентная неполярная водородная 5.в узлах кристалической решетки калий гидроксида находится а.ионы б.молекулы в.атомы и ионы г.атомы 6.Выберите ряд соединений с ковалентной полярной связью а.HCL NaCL Al2O3 б.NO CO H2SO4 в.KCI CaO H2 г.Na I2 H2O 7,степень окисления азота в нитрате серебра а.+3 б.2 в.5 г.-3 8.Высшая валентность атома серы проявляется в соединении а.SO2 б.H2SO4 в.H2S г.s 9/ укажите валентность и степень окисления атомов азота в молекуле N2 а.III и 0 б.III и +2 в.II -2 г.I и 0 Спасибо.